| Головна » Хімія |
Цілі уроку:закріпити знання учнів про хімічні властивості основ; розвивати вміння й навички проведення хімічного експерименту, складання рівнянь хімічних реакцій на прикладі хімічних властивостей лугів і нерозчинних основ.
Тип уроку:формування вмінь і навичок, урок-дослідження.
Форми роботи:лабораторна робота, робота з опорною схемою.
Обладнання:Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, хімічні реактиви, плакат «Правила техніки безпеки в кабінеті хімії».
ХІД УРОКУ
І. Організація класу
ІІ.Перевірка домашнього завдання, актуалізація опорних знань
1. BaO+H2O→Ba(OH)2
2. CO2+H2O→ H2CO3
3, 4. Ba(OH)2+H2CO3→BaCO3+ 2H2O
Роботазопорноюсхемою«Хімічні властивості основ»
- На основі знань про хімічні властивості основ заповнимо опорну схему «Хімічні властивості основ».
- Згадаймо, яких правил необхідно дотримуватися в хімічній лабораторії. (Звертаємося до таблиці «Правила техніки безпеки в кабінеті хімії».)
ІІІ. Формування навичок і вмінь
Лабораторна робота № 4. Взаємодія розчинів лугів з кислотами
У дві пробірки наливаємо по 1 мл NaOH і по одній-дві краплі фенолфталеїну. Потім в одну з них по краплях додаємо хлоридну кислоту, у другу - сульфатну кислоту. Заносимо результати до протоколу.
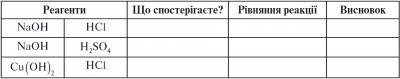
Лабораторна робота № 5. Взаємодія нерозчинних основ з кислотами
Нам необхідно одержати купрум(II) гідроксид. Як це зробити? Яку властивість основ для цього можна використати?
CuSO4+2NaO → Cu(OH)2↓+Na2SO4
До одержаного осаду по краплях додаємо хлоридну кислоту.
- Які ознаки хімічної реакції спостерігаємо?
Запишіть результати досліду до протоколу.
Лабораторна робота № 6. Розкладання нерозчинних основ у процесі нагрівання
Нерозчинні основи за нагрівання розкладаються на оксид і воду.
Перевіримо це на практиці.
Одержіть купрум(II) гідроксид, закріпіть пробірку в пробіркотримачі.
- Як правильно нагріти пробірку?
- В якій частині полум’я необхідно нагрівати пробірку? (У верхній,найбільш гарячій)
- Що спостерігаємо? Запишемо рівняння реакції:
Cu(OH)2→CuO+H2O
Укажіть тип реакції. (Реакція розкладу)
Висновок.З якими властивостями основ ми познайомилися на цьому уроці?
- Реакція нейтралізації.
- Розклад нерозчинних основ.
IV. Закріплення вивченого матеріалу
Керованапрактика
Завдання 1.Обчисліть кількість речовини води, що утвориться внаслідок нагрівання алюміній гідроксиду масою 15,6 г.

Завдання 2.Здійсніть перетворення:
Cu(OH)2→CuO→CuSO4→Cu(OH)2
1) Cu(OH)2→CuO+H2O
2) CuO+H2SO4→CuSO4+H2O
3) CuSO4+2NaOH→ Cu(OH)2+2H2O
V.Домашнєзавдання
Опрацювати відповідний параграф підручника, виконати завдання до нього.
Творче завдання.Підготувати повідомлення про використання основ.
|
|
Схожі презентації:
