| Головна » Хімія |
Цілі уроку:ознайомити учнів з фізичними властивостями основ; закріпити знання про класифікації основ на розчинні й нерозчинні; розширити знання учнів про хімічні властивості класів неорганічних сполук на прикладі основ; показати дію лугів на індикатори; розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей основ.
Тип уроку:поглиблення й розширення знань.
Форми роботи:розповідь учителя, демонстраційний експеримент, лабораторні досліди, робота з опорною схемою.
Обладнання:Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, таблиця «Правила техніки безпеки в кабінеті хімії», ряд активності металів, хімічні реактиви.
ХІД УРОКУ
І. Організація класу
ІІ. Аналіз тематичного оцінювання
Робота з класом зі з’ясування типових помилок, індивідуальна робота над помилками.
ІІІ. Актуалізація опорних знань, мотивація навчальної діяльності
- Який клас неорганічних сполук називається основами?
- На які дві групи поділяються основи? (Розчинні (луги) й нерозчинні(малорозчинні))
- З допомогою таблиці розчинності наведіть приклади розчинних і нерозчинних основ. (П’ятеро-шестеро учнів по ланцюжку виписують на дошці формули основ.)
- Назвіть записані основи за сучасною українською номенклатурою. (По ланцюжку наступні учні називають основи.)
- З допомогою таблиці «Взаємозв’язок між класами неорганічних сполук», що є у вас у зошитах, припустіть, які хімічні властивості проявлятимуть основи.
1) Взаємодія з кислотами.
2) Взаємодія з кислотними оксидами.
Додаємо:
3) Взаємодія із солями.
І за цим планом будемо вивчати властивості основ.
IV. Вивчення нового матеріалу
1.Лабораторна робота № 3. Дія лугів на індикатори
Для проведення цієї лабораторної роботи ми використаємо пластинку для мікрометоду.
Акуратно в перший ряд капаємо по дві краплі натрій гідроксиду, у другий ряд - по дві краплі кальцій гідроксиду. Далі в перше заглиблення з кислотами додаємо одну краплю метилового оранжевого, у друге - одну краплю лакмусу, у третє - одну краплю фенолфталеїну.
На основі спостережень заповнюємо таблицю.
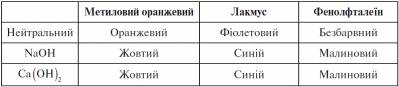
Висновок.У розчинах лугів метиловий оранжевий набуває жовтого забарвлення, лакмус - синього, фенолфталеїн - малинового. Отже, розчини лугів можна визначити з допомогою індикатора.
2.Демонстрація 7. Хімічні властивості основ
На початку уроку ми припустили, які властивості повинні мати основи. Подивимося практично.
Дослід 1.Взаємодія лугів з кислотними оксидами
Збираємо прилад для одержання вуглекислого газу. Одержаний газ пропускаємо крізь розчин кальцій гідроксиду.
- Яку ознаку реакції спостерігаємо? (Випадіння осаду) Записуємо рівняння реакції:
CO2+Ca(OH)2→CaCO3+H2O
Укажіть тип реакції. (Реакція обміну)
Дослід 2.Взаємодія лугів з кислотами
- Як називається ця реакція? (Нейтралізації)
- Яка речовина допоможе побачити, що реакція відбулася? (Індикатор)
У дві пробірки наливаємо NaOH і Ca(OH)2, додаємо фенолфталеїн.
А потім по краплях знебарвлюємо розчин хлоридною кислотою.Пропонуємо учням записати рівняння реакцій:
NaOH+HCl→NaCl +H2O
Ca(OH)2+2HCl→CaCl2+2H2O
Дослід 3.Взаємодія лугів із солями
У дві пробірки наливаємо CuSO4, Al2(SO4)3, потім по краплях додаємо розчин їдкого натру.
- Які ознаки реакції спостерігаємо? (Утворення нерозчинного осаду)
Запишемо рівняння реакції:
CuSO4+2NaOH→NaSO4+Cu(OH)2↓
Al2(SO4)3+6NaOH→ 2Al(OH)3+3Na2SO4↓
Усі наші припущення про властивості лугів підтвердилися практично. (Розглядаємо відповідно до пунктів плану.)
На основі цього вносимо доповнення в таблицю «Взаємозв’язок між класами неорганічних сполук».
V. Закріплення вивченого матеріалу
Керованапрактика
Завдання 1.Здійснити перетворення:
CaO→Ca(OH)2→CaSO4←H2SO4←SO3
Знання властивостей класів неорганічних сполук дозволяє нам припустити, з допомогою яких реакцій можна одержати ту чи іншу речовину.
Два учні з двох боків:
CaO+H2O→Ca(OH)2
Ca(OH)2+H2SO4→CaSO4+2H2O
SO3+H2O→H2SO4
H2SO4+Ca(OH)2→CaSO4+H2O
Завдання2.Здійснитиперетворення:
а) Mg→MgO→Mg(NO3)2→Mg(OH)2
б) Ba→BaO→Ba(OH)2→Ba(NO3)2
VI.Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання до нього, виконати вправи.
Здійснити перетворення:
BaO→Ba(OH)2→BaCO3←H2CO3←CO2
|
|
Схожі презентації:
